

作者: 发布时间:2024-02-06
2月4日
国家药监局发布
《2023年度药品审评报告》
(以下简称“报告”)
文末附全文二维码
报告显示
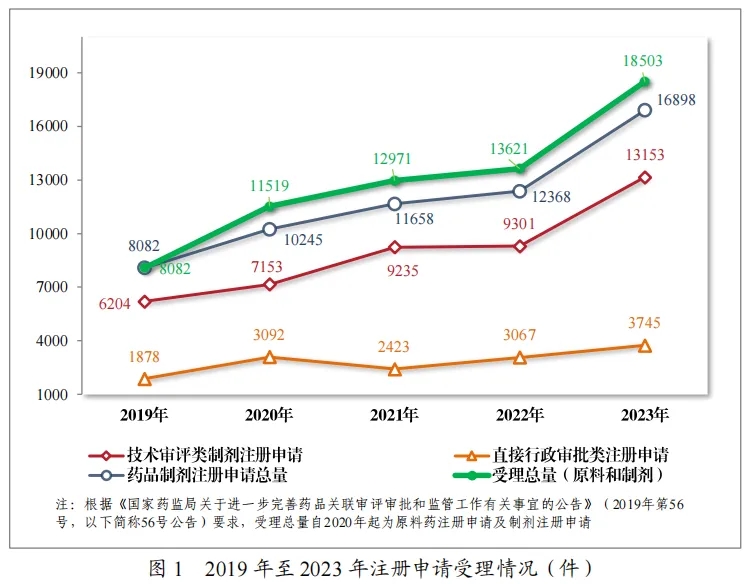
2023年,药品注册申请申报量持续增长,药审中心受理各类注册申请18503件(同比增加35.84%),包括药品制剂注册申请16898件(同比增加36.63%);化学原料药注册申请1605件(同比增加28.09%)。
16898件药品制剂注册申请包括技术审评类注册申请13153件(同比增加41.41%,包括13144件药品,9件药械组合),直接行政审批类注册申请3745件(同比增加22.11%,包括补充申请和一次性进口)。
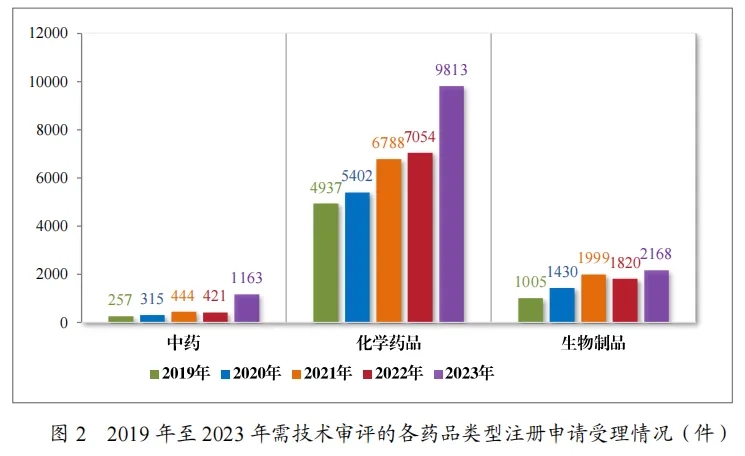
2023年受理的13144件技术审评类药品注册申请中,以药品类型统计,中药注册申请1163件,同比增加176.25%;化学药品注册申请9813件,同比增加39.11%,,占全部需技术审评的药品注册申请受理量的74.66%;生物制品注册申请2168件,同比增加19.12%。
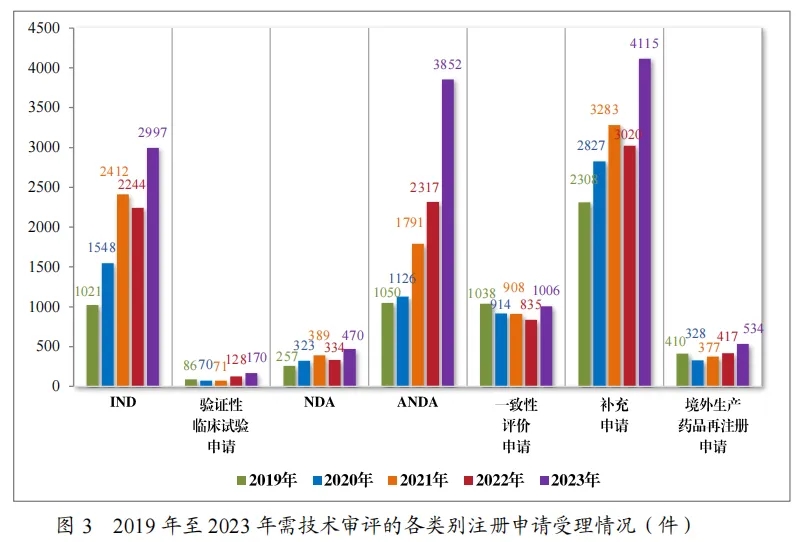
以注册申请类别统计,受理新药临床试验申请(该注册申请类别以下简称“IND”)2997件,同比增加33.56%;验证性临床试验申请170件,比2022年增加32.81%;新药上市许可申请(该注册申请类别以下简称“NDA”)470件,同比增加 40.72%;同名同方药、化学仿制药上市许可申请(该注册申请类别以下简称“ANDA”)3852件,同比增加66.25%;仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称“一致性评价申请”)1006件,同比增加20.48%;补充申请4115件,同比增加36.26%;境外生产药品再注册申请534件,同比增加28.06%。
扫描二维码查看报告全文
