作者: 发布时间:2023-07-17
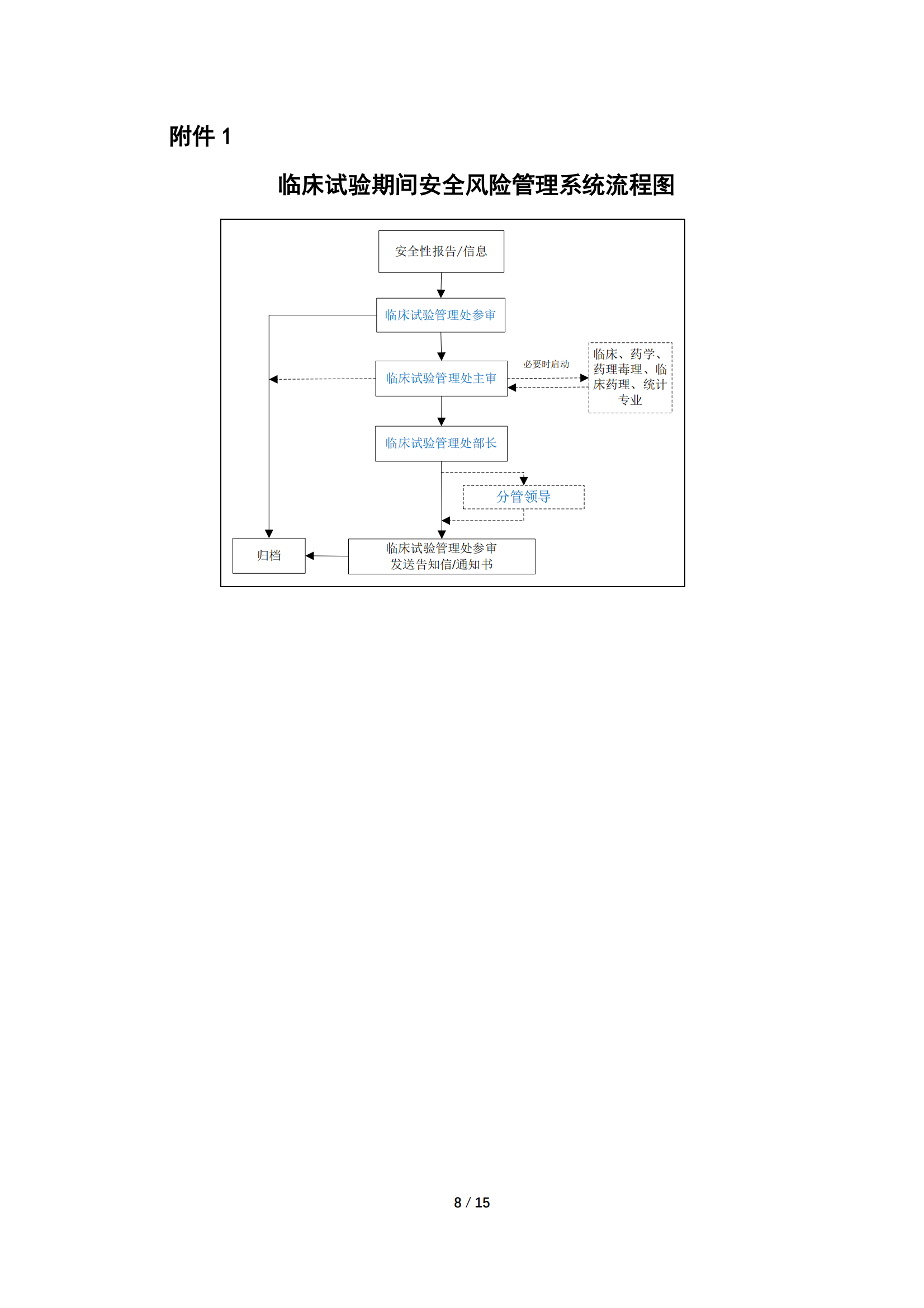
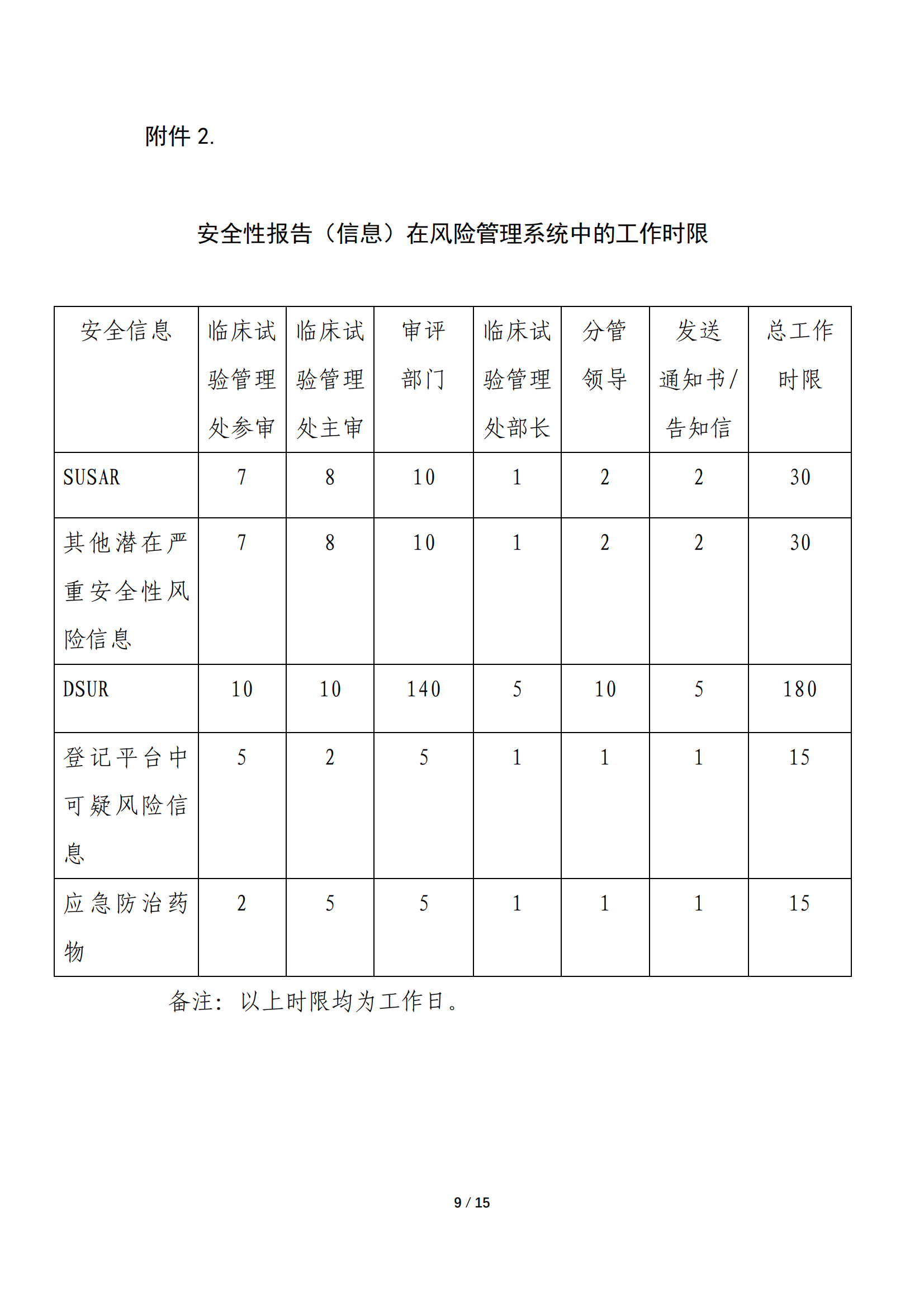
为规范药审中心临床试验期间安全信息评估与风险管理工作,2021年1月药审中心在内部发布实施了《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》。基于近两年实施过程中任务启动与风险处理情况的汇总分析、NRA CT模块需完善的问题、以及重点问题的跨部门风险评估要求,我们对该内部工作程序进行了修订。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起2周。
您的反馈意见请发到以下联系人的邮箱:
联系人:刘文东,崔灿
联系方式:liuwd@cde.org.cn, cuic@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2023年7月10日